Phương pháp thủy phân và sản xuất NaOH: Có mối liên hệ nào?
April 19, 2025 6:01 - Pas de commentaireSản Xuất NaOH Bằng Phương Pháp Thủy Phân: Ưu Điểm, Nhược Điểm & Ứng Dụng
Mô tả ngắn: Tìm hiểu về phương thức thủy phân vào tạo ra NaOH (xút): các bước, điểm mạnh, điểm yếu kém so cùng với các phương thức khác và những phần mềm tiềm năng.
Trong thế giới công nghiệp hiện đại, NaOH (Natri Hydroxit), hoặc còn gọi là xút, đóng góp vai trò cực kì quan trọng. Từ sản xuất giấy, dệt nhuộm, xà chống, hóa học làm sạch cọ đến xử lý nước, hóa dầu và nhiều ngành công nghiệp không giống, NaOH là một hóa chất không thể thiếu thốn. Nhu cầu tạo ra NaOH ngày càng tăng, thúc đẩy các Nhà CửA khoa học tập và kỹ sư ko ngừng mò kiếm những cách phát triển hiệu trái, tiết kiệm ngân sách và thân thiện với môi ngôi trường.
Hiện nay, có kha khá nhiều cách sản xuất NaOH không giống nhau, bao bao gồm phương thức năng lượng điện phân dung dịch muối bột ăn (NaCl), cách hóa học (sữa vôi, Ferit),... Mỗi cách đều có những ưu thế và điểm yếu kém riêng. Trong số đó, phương thức thủy phân nổi lên như 1 biện pháp tiềm năng, hứa hẹn mang lại nhiều quyền lợi về tài chính và môi trường.
Vậy, sản xuất NaOH bằng cách thủy phân là gì? Phương pháp này còn có những ưu thế và nhược điểm gì so với những cách khác? Ứng dụng của chính nó trong thực tiễn ra sao? Chúng ta hãy cùng nhau nhà giam phá trong bài xích viết này.
Nguyên tắc cơ bản của phương thức thủy phân trong tạo ra NaOH
Để nắm rõ về phương pháp phát triển NaOH bằng phương pháp thủy phân, trước tiên chúng ta cần thiết cầm vững phương pháp cơ bạn dạng của chính nó.
Định nghĩa thủy phân: Thủy phân là thừa trình phân giải một hóa học bởi nước. Trong phản ứng thủy phân, những phân tử nước sẽ tính năng cùng với hóa học cần thiết phân giải, đánh tan những liên kết hóa học và tạo thành những thành phầm mới nhất.
Phản ứng thủy phân điển hình để phát triển NaOH:
Trong phát triển NaOH, phương thức thủy phân thông thường được được áp dụng nhằm thủy phân muối hạt của kim loại kiềm, ví như Quy trình sản xuất xút (Na2CO3). Na2CO3 có thể được mò thấy trong tự nhiên dưới dạng khoáng chất hoặc được phát triển từ tro soda.
Phương trình phản xạ hóa học tập:
Na2CO3 + H2O → 2NaOH + CO2
Điều khiếu nại phản ứng:
Nhiệt độ: Phản ứng thủy phân thông thường được thực hiện ở nhiệt độ cao nhằm tăng vận tốc phản xạ và độ hòa tan của những chất.
Áp suất: Áp suất cao hoàn toàn có thể giúp tăng hiệu suất phản ứng, quánh biệt là Khi có sự nhập cuộc của các hóa học khí.
Chất xúc tác: Một số hóa học xúc tác có thể được dùng nhằm tăng vận tốc phản ứng và hạn chế nhiệt độ độ cần thiết thiết.
Cơ chế phản ứng:
Phản ứng thủy phân Na2CO3 ra mắt theo cơ chế sau:
Na2CO3 hòa tan trong nước, tạo ra thành những ion Na+ và CO32-.
Ion CO32- tính năng với nước, nhận một proton (H+) từ nước và tạo thành ion HCO3- (Bicarbonat). Đồng thời, một ion OH- (Hydroxit) được giải phóng.
Ion HCO3- tiếp tục thuộc tính với nước, nhận thêm một proton và tạo nên thành H2CO3 (Axit Carbonic). Đồng thời, một ion OH- tiếp tục được phóng thích.
H2CO3 không bền, phân hủy thành CO2 và H2O.
Các ion OH- được giải phóng trong quá trình phản xạ sẽ phối hợp với các ion Na+ để tạo nên thành NaOH.
Ví dụ rõ ràng:
Trong phòng thử nghiệm, quá trình thủy phân Na2CO3 rất có thể được thực hiện bởi cơ hội đun nóng dung dịch Na2CO3 vào nước. Khí CO2 sinh ra sẽ tiến hành tích lũy và NaOH sẽ được nhận được sau Khi cô cạn hỗn hợp.
Trong quy tế bào công nghiệp nhỏ, vượt trình thủy phân hoàn toàn có thể được thực hiện nay vào những lò phản ứng sệt biệt, được design để Chịu được nhiệt độ và áp suất cao.
2. Ưu điểm của phương pháp thủy phân so cùng với những cách khác
So cùng với các phương thức tạo ra NaOH truyền thống lâu đời, phương pháp thủy phân mang lại nhiều điểm mạnh vượt lên trội:
Tiềm năng sử dụng nguyên liệu input đầu vào rẻ chi phí và dễ dàng kiếm:
Thay vì dùng muối hạt ăn (NaCl), cách thủy phân hoàn toàn có thể dùng tro soda (chứa Na2CO3) thực hiện nguyên liệu input đầu vào. Tro soda là một trong các những nguồn khoáng sản tự nhiên dồi dào và có giá thành rẻ hơn so cùng với muối hạt ăn.
Vấn đề này giúp giảm phung phí phát triển NaOH và tăng tính đối đầu của sản phẩm.
Ít tiêu thụ năng lượng rộng so với phương pháp năng lượng điện phân:
Phương pháp năng lượng điện phân đòi hỏi một lượng rộng lớn điện năng để phân giải muối hạt ăn thành NaOH, clo và hydro.
Trong lúc đó, cách thủy phân chỉ muốn một lượng nhiệt nhỏ nhằm đun nóng hỗn hợp phản ứng.
Ít gây ô nhiễm môi ngôi trường rộng:
Một số công nghệ năng lượng điện phân dùng thủy ngân hoặc amiăng, là những hóa học độc sợ hãi khiến ô nhiễm môi ngôi trường nguy hiểm.
Phương pháp thủy phân không sử dụng những chất này, vì thế hạn chế thiểu nguy hại độc hại môi ngôi trường.
Khí CO2 sinh ra trong thừa trình thủy phân rất có thể được thu hồi và sử dụng cho các mục đích khác, ví dụ như sản xuất nước giải khát hoặc phân bón.
Quy trình giản dị rộng:
Phương pháp thủy phân có ít quy trình và thiết bị rộng so cùng với phương thức năng lượng điện phân.
Vấn đề này giúp giảm chi phí đầu tư chi tiêu và vận hành nhà cửa máy sản xuất NaOH.
3. Nhược điểm và thử thách của phương thức thủy phân
Mặc cho dù có nhiều ưu thế, phương thức sản xuất NaOH bởi phương thức thủy phân cũng tồn trên một trong những điểm yếu và thử thách:
Hiệu suất phản xạ hoàn toàn có thể thấp:
Phản ứng thủy phân là một trong những phản xạ thuận nghịch, vì thế hiệu suất phản xạ rất có thể bị số lượng giới hạn bởi vì cân nặng bởi hóa học.
Cần tối ưu hóa những điều kiện phản xạ như nhiệt độ, áp suất, mật độ chất phản ứng và hóa học xúc tác nhằm tăng hiệu suất phản xạ.
Sản phẩm rất có thể lẫn tạp hóa học:
NaOH phát triển kể từ phương thức thủy phân hoàn toàn có thể lẫn những tạp chất như Na2CO3, muối và các hóa học cơ học.
Cần có các bước tinh chế để thu được NaOH có tính tinh khiết cao, đáp ứng nhu cầu yêu thương cầu của những phần mềm khác nhau.
Khó rà soát phản xạ:
Phản ứng thủy phân có thể tạo nên ra các thành phầm phụ không mong mong muốn, làm tránh hiệu suất và độ tinh khiết của sản phẩm.
Cần kiểm soát ngặt nghèo các điều kiện phản ứng nhằm giới hạn sự hình thành những thành phầm phụ.
Chưa được phần mềm rộng lớn rãi vào công nghiệp:
Mặc dù có nhiều tiềm năng, phương pháp thủy phân không được phần mềm rộng rãi vào công nghiệp tạo ra NaOH.
Cần được thêm phân tích và vạc triển để hoàn thiện technology và ứng dụng phương pháp này ở quy mô rộng lớn.
4. Các yếu đuối tố ảnh hưởng trọn đến hiệu trái của vượt trình thủy phân
Hiệu quả của thừa trình tạo ra NaOH bằng cách thủy phân phụ thuộc vào nhiều yếu ớt tố, bao gồm:
Nhiệt độ:
Nhiệt độ cao làm tăng tốc độ phản xạ và độ hòa tan của những chất phản ứng.
Tuy nhiên, nhiệt độ độ quá cao rất có thể làm phân hủy những hóa học phản xạ hoặc thành phầm, thực hiện hạn chế hiệu suất phản ứng.
Nhiệt độ tối ưu cho phản xạ thủy phân Na2CO3 thông thường nằm trong khoảng tầm 100-200°C.
Áp suất:
Áp suất cao có thể góp tăng hiệu suất phản xạ, quánh biệt là lúc có sự tham gia của các hóa học khí như CO2.
Áp suất cao cũng giúp tăng độ hòa tan của những hóa học phản ứng, tạo nên điều khiếu nại thuận lợi cho phản ứng xảy ra.
Áp suất tối ưu đến phản ứng thủy phân Na2CO3 thông thường nằm trong khoảng 1-10 bar.
Nồng độ hóa học phản xạ:
Nồng độ chất phản ứng cao làm tăng tốc độ phản xạ và hiệu suất.
Tuy nhiên, độ đậm đặc quá cao có thể làm tăng cường độ nhớt của dung dịch, khiến khó giẻ cho quá trình khuấy trộn và truyền sức nóng.
Nồng độ tối ưu mang đến phản xạ thủy phân Na2CO3 thường nằm trong khoảng tầm 10-30%.
Chất xúc tác:
Một số chất xúc tác có thể được dùng để tăng tốc độ phản ứng và hiệu suất.
Ví dụ, các oxit kim loại như MgO, CaO, ZnO hoàn toàn có thể được sử dụng thực hiện chất xúc tác cho phản ứng thủy phân Na2CO3.
Cơ chế tạo dụng của chất xúc tác là tạo ra các trung tâm hoạt động và sinh hoạt trên bề mặt, góp hấp phụ và hoạt hóa những hóa học phản xạ.
pH:
pH ảnh tận hưởng đến cân bởi phản xạ và sự ổn định của sản phẩm.
Phản ứng thủy phân Na2CO3 ra mắt chất lượng nhất trong môi trường kiềm.
pH thừa cao hoàn toàn có thể làm phân hủy NaOH, thực hiện giảm hiệu suất phản xạ.
pH tối ưu cho phản xạ thủy phân Na2CO3 thông thường nằm trong khoảng 10-12.
5. Các nghiên cứu và phân tích và phần mềm hiện tại của cách thủy phân vào sản xuất NaOH
Mặc dù chưa được ứng dụng rộng rãi vào công nghiệp, cách tạo ra NaOH bởi phương pháp thủy phân đã thú vị sự quan tiền tâm của đa số nhà cửa nghiên cứu và phân tích và kỹ sư.
Nghiên cứu trong phòng thực nghiệm:
Các phân tích tập trung vào tối ưu hóa điều khiếu nại phản ứng, dùng chất xúc tác mới, phát triển các các bước tinh luyện sản phẩm, v.v.
Ví dụ, một phân tích của Đại học tập Bách khoa Hà Thành đã mò ra rằng việc dùng chất xúc tác MgO nano có thể làm tăng hiệu suất phản ứng thủy phân Na2CO3 lên tới 90%.
Ứng dụng vào quy tế bào pilot:
Một số công ty lớn và tổ chức triển khai nghiên cứu và phân tích đã tiến hành demo nghiệm phát triển NaOH bằng cách thủy phân ở quy mô nhỏ (pilot).
Mục tiêu của các test nghiệm này là đánh giá tiền tính khả thi về tài chính và chuyên môn của phương thức, giống như thu thập dữ liệu để kiến thiết nhà cửa máy tạo ra NaOH quy mô rộng lớn.
Các bởi sáng sủa chế liên quan tiền đến phương thức thủy phân:
đa phần công nghệ và các bước tạo ra NaOH bằng cách thủy phân đang được cấp cho bởi sáng sủa chế.
Các bởi sáng chế này bảo đảm an toàn quyền sở hữu trí tuệ của những nhà vạc minh và khuyến khích sự đổi mới mẻ trong nghành nghề này.
6. So sánh phương thức thủy phân với các phương pháp sản xuất NaOH không giống
Để có dòng trông tổng quan lại về phương pháp sản xuất NaOH bởi phương pháp thủy phân, con người ta hãy đối chiếu nó với những phương pháp sản xuất NaOH không giống:
Phương pháp điện phân dung dịch muối hạt ăn (NaCl):
Ưu điểm: Sản phẩm có độ tinh khiết cao, technology đã được phát triển rộng rãi.
Nhược điểm: Tiêu thụ nhiều tích điện, có thể tạo ô nhiễm môi trường (thủy ngân, amiăng).
Phương pháp hóa học tập (sữa vôi, Ferit):
Ưu điểm: Đơn giản, dễ dàng thực hiện.
Nhược điểm: Sản phẩm có tính tinh khiết thấp, tạo ra nhiều hóa học thải.
7. Tiềm năng vạc triển của phương thức thủy phân trong tương lai
Phương pháp sản xuất NaOH bởi phương thức thủy phân có tiềm năng cực kỳ lớn để phát triển trong sau này, quánh biệt là trong đồ họa những mối cung cấp khoáng sản thiên nhiên càng ngày càng hết sạch và yêu thương cầu bảo đảm an toàn môi trường ngày càng tốt.
Nghiên cứu và phát triển các chất xúc tác mới:
Việc mò tìm và phát triển những chất xúc tác mới nhất có hoạt tính cao, ổn định và chi phí thành rẻ là một trong những phía phân tích quan tiền trọng nhất nhằm nâng lên hiệu trái của phương thức thủy phân.
Các hóa học xúc tác nano, vật liệu zeolit và những phức hóa học kim chủng loại là những ứng cử viên tiềm năng cho vai trò này.
Tối ưu hóa quy trình sản xuất:
Việc tối ưu hóa những điều kiện phản ứng, thiết kế lò phản xạ hiệu trái và tích hợp các quy trình xử lý thành phầm là những yếu tố quan tiền trọng để tránh chi phí tạo ra NaOH và tăng tính đối đầu của phương pháp thủy phân.
Ứng dụng các công nghệ hiện đại như tế bào phỏng quá trình, tinh chỉnh và điều khiển tự động và phân tách data rộng lớn có thể giúp tối ưu hóa các bước tạo ra một cơ hội hiệu trái.
Ứng dụng vào sản xuất NaOH quy tế bào nhỏ:
Phương pháp thủy phân đặc biệt tương thích mang đến những vùng có nguồn nguyên liệu Na2CO3 dồi dào, nhưng nhu yếu sử dụng NaOH không rộng lớn.
Các nhà máy tạo ra NaOH quy tế bào nhỏ rất có thể được xây dựng ngay sát các mỏ khoáng sản hoặc các nhà máy tạo ra tro soda, giúp hạn chế chi phí vận đưa và đáp ứng mối cung cấp cung nguyên vật liệu ổn định.
Kết hợp với những phương thức không giống:
Phương pháp thủy phân rất có thể được kết hợp cùng với các cách tạo ra NaOH không giống để tận dụng tối đa ưu điểm của từng cách.
Ví dụ, NaOH tạo ra kể từ phương pháp thủy phân rất có thể được tinh chế bởi phương pháp điện phân để đạt được độ tinh khiết cao. Hoặc khí CO2 sinh ra từ quá trình thủy phân có thể được dùng làm nguyên vật liệu đến thừa trình điện phân để hạn chế tiêu thụ tích điện.
Kết luận
Sản xuất NaOH bởi phương pháp thủy phân là một phương pháp tiềm năng, hứa hẹn mang lại nhiều quyền lợi về kinh tế tài chính và môi ngôi trường. Mặc dù còn tồn tại một số trong những thách thức, phương thức này đang ngày càng được quan lại tâm và nghiên cứu vạc triển.
Với những ưu điểm như dùng nguyên vật liệu rẻ chi phí, ít tiêu thụ tích điện và ít gây độc hại môi trường, phương pháp thủy phân có thể đóng góp góp vào việc tạo ra NaOH một cách bền vững và thân thiện cùng với môi ngôi trường.
Trong sau này, chúng ta rất có thể kỳ vọng vào những tiến cỗ vượt bậc vào technology thủy phân, mở ra những cơ hội mới mẻ cho ngành công nghiệp hóa chất và thêm phần vào sự phạt triển bền vững vàng của xã hội.
Natri có tồn tại ở dạng nào trong tự nhiên không?
April 19, 2025 5:47 - Pas de commentaireNatri Trong Tự Nhiên Tồn Tại Ở Dạng Nào? Khám Phá Các Hợp Chất Phổ Biến
Mô tả ngắn: Natri là một trong nguyên tố hoạt động mạnh, vậy nó tồn tại ở dạng nào vào tự động nhiên? Bài viết này khám phá những hợp chất natri phổ biến chuyển nhất trong tự động nhiên, từ muối ăn đến những khoáng hóa học quan tiền trọng.
Mở bài
Natri (Na) là một trong nguyên tố hóa học cực kì quan lại trọng, đóng vai trò thiết yếu trong cả đời sống sinh học và những các bước công nghiệp. Chúng ta dùng natri mặt hàng ngày, kể từ việc nêm và nếm thức ăn đến các phần mềm công nghiệp rộng lớn rộng lớn. Tuy nhiên, bạn có lúc nào tự hỏi, vào tự động nhiên, natri tồn tại ở dạng nào?
Do tính hóa học hóa học tập quánh biệt, natri là một trong các những kim loại kiềm sinh hoạt mạnh. Điều này có tức thị nó ko tồn tại ở dạng tự động do, đơn chất trong tự động nhiên. Thay vào đó, natri luôn kết hợp với các nguyên tố không giống để tạo nên thành những hợp chất bền vững.
Quá trình địa chất tạo ra NaOH , natri vào tự nhiên tồn tại ở dạng nà và các hợp chất đó có vai trò gì? Chúng ta hãy cùng nhau nhau nhà giam phá vào bài xích viết này.
Thân bài bác
Vì sao natri không tồn tại ở dạng đơn hóa học vào tự động nhiên?
Để hiểu rõ vì sao natri ko tồn tại ở dạng đơn hóa học trong tự nhiên, chúng ta cần coi xét tính chất hóa học đặc trưng của chính nó:
Tính chất hóa học của natri:
Natri là một kim loại kiềm, nằm trong nhóm 1A vào bảng tuần trả các thành phần hóa học tập. Nó có thông số kỹ thuật electron lớp bên ngoài cùng là 1s2 2s2 2p6 3s1.
Do chỉ có một electron ở lớp bên ngoài cùng, natri dễ dàng dàng nhường electron này để đạt được cấu hình electron bền vững của khí khan hiếm neon (Ne).
Quá trình nhường electron này tạo ra ra ion natri dương (Na+), mang điện tích +1.
Natri có ái lực rộng lớn cùng với các hóa học lão hóa như oxy, nước, clo, v.v. Nó phản xạ mạnh mẽ và uy lực với các hóa học này nhằm tạo thành những hợp hóa học bền vững.
Phản ứng của natri với oxy trong không khí:
Natri dễ dàng dàng bị lão hóa do oxy trong ko khí, tạo thành natri oxit (Na2O).
Phương trình phản ứng: 4Na + O2 → 2Na2O (Natri oxit)
Phản ứng này diễn ra ngay cả ở nhiệt độ độ phòng, khiến cho mang đến natri nhanh chóng bị xỉn color Khi xúc tiếp với ko khí.
Phản ứng của natri cùng với nước:
Natri phản xạ mạnh mẽ với nước, tạo ra thành natri hydroxit (NaOH) và khí hydro (H2).
Phương trình phản ứng: 2Na + 2H2O → 2NaOH + H2
Phản ứng này lan nhiệt mạnh và rất có thể gây nổ và cháy nếu như ko được rà soát. Khí hydro sinh ra cũng là một chất dễ dàng cháy.
Đây là một trong vào những nguyên do chính khiến cho natri ko thể tồn tại ở dạng đơn hóa học vào môi trường tự động nhiên ẩm ướt.
Kết luận:
Do tính hoạt động hóa học cao, natri luôn tồn trên ở dạng hợp chất vào tự nhiên. Nó dễ dàng dàng phản xạ với những chất lão hóa như oxy và nước nhằm tạo thành các hợp chất bền vững vàng rộng.
Các hợp chất natri phổ biến đổi trong tự nhiên
Trong tự nhiên, natri tồn trên công ty yếu đuối ở dạng những hợp hóa học ion, trong đó ion Na+ tương tự cùng với những ion âm không giống. Một số hợp hóa học natri phổ biến nhất bao gồm:
Muối ăn (NaCl - Natri clorua):
Nguồn gốc:
Nước biển khơi: Chiếm khoảng 3% lượng nước biển cả. Đây là nguồn cung cấp cho muối bột ăn rộng lớn nhất bên trên thế giới.
Mỏ muối: Các lớp muối hạt khoáng tạo hình do sự bay khá của biển khơi cổ đại. Các mỏ muối hạt rất có thể nằm sâu bên dưới lòng đất hoặc lộ thiên bên trên bề mặt.
Vai trò:
Quan trọng cho sự sinh sống của con người và con vật. Natri clorua là một trong những chất điện giải thiết yếu đuối, giúp giữ cân bởi nước và điện giải trong cơ thể. Nó cũng tham gia vào vượt trình truyền dẫn xung thần kinh trung ương và co cơ.
Nguyên liệu quan trọng vào công nghiệp hóa chất (sản xuất NaOH, clo, axit clohidric, v.v.). Muối ăn là nguyên liệu đầu vào mang đến vượt trình điện phân để sản xuất NaOH và khí clo, hai hóa hóa học quan tiền trọng vào nhiều ngành công nghiệp.
Phân tía: Rộng khắp trên trái đất, cả trên đất ngay lập tức và dưới biển khơi. Các mỏ muối hạt rộng lớn được mò thấy ở nhiều quốc gia như Trung Quốc, Hoa Kỳ, Đức, Ấn Độ, v.v.
Ví dụ ví dụ:
Mỏ muối hạt Khewra ở Pakistan: Một vào những mỏ muối hạt rộng lớn nhất và thọ đời nhất trên thế giới. Mỏ muối hạt này được khai thác kể từ thời Alexander Đại đế và vẫn đang được hoạt động mang đến đến thời buổi này.
Biển Chết: Một hồ nước mặn có độ đậm đặc muối rất cao (khoảng 34%). Do nồng độ muối hạt quá cao, hầu hết ko có sinh vật nào hoàn toàn có thể sinh sống được ở Biển Chết.
Natri cacbonat (Na2CO3) và natri bicacbonat (NaHCO3):
Nguồn gốc:
Khoáng chất tự nhiên: Trona, natron, v.v. Trona là một khoáng chất cacbonat ngậm nước có bộ phận Na2CO3·NaHCO3·2H2O. Natron là một trong khoáng chất cacbonat ngậm nước có thành phần Na2CO3·10H2O.
Nước khoáng: Một số mối cung cấp nước khoáng chứa chấp natri cacbonat và bicacbonat hòa tan.
Vai trò:
Natri cacbonat: Sử dụng trong tạo ra thủy tinh, chất làm sạch cọ, giấy, v.v. Natri cacbonat là một trong hóa học kiềm mạnh, được sử dụng nhằm làm mềm nước, điều hòa độ pH và thực hiện sạch các mặt phẳng.
Natri bicacbonat: Sử dụng trong thực phẩm (bột nở), dược phẩm (thuốc kháng axit), chất chữa cháy, v.v. Natri bicacbonat là một hóa học lưỡng tính, rất có thể phản ứng với cả axit và bazơ. Nó được dùng làm bột nở trong thực hiện bánh, thực hiện dung dịch kháng axit nhằm trung hòa axit vào dạ dày, và thực hiện chất chữa cháy nhằm dập tắt những vụ cháy nổ nhỏ.
Phân cha:
Các mỏ khoáng chất natri cacbonat và bicacbonat tập trung ở một trong những khu vực bên trên thế giới (ví dụ: Hoa Kỳ, Thổ Nhĩ Kỳ, Kenya, v.v.).
Ví dụ rõ ràng:
Mỏ trona ở Green River, Wyoming, Hoa Kỳ: Một trong những mỏ trona lớn nhất trên toàn cầu. Mỏ trona này cung cấp cho phần lớn natri cacbonat cho thị ngôi trường Hoa Kỳ và quốc tế.
Các khoáng hóa học chứa natri khác:
Feldspar (ví dụ: albite - NaAlSi3O8):
Là một group khoáng chất silicat phổ biến chuyển trong vỏ Trái Đất.
Chứa natri, kali, can xi, và những thành phần không giống.
Feldspar là một trong bộ phận quan lại trọng của không ít chủng loại đá, bao gồm granite, basalt, và gneiss.
Zeolite:
Là một group khoáng hóa học aluminosilicat có cấu hình xốp.
Sử dụng vào các phần mềm hấp phụ, trao đổi ion, và xúc tác.
Zeolite có kỹ năng hấp phụ các hóa học khí, chất lỏng và các ion khác, và được sử dụng vào nhiều phần mềm như xử lý nước, làm khô khí, và xúc tác vào những phản ứng hóa học.
Borax (Na2B4O7·10H2O):
Là một khoáng hóa học borat được dùng trong sản xuất chất làm sạch rửa, thủy tinh, và những thành phầm không giống.
Borax là một trong chất tẩy cọ tự nhiên, được sử dụng nhằm thực hiện sạch ăn mặc quần áo, đồ gia dụng và các mặt phẳng khác. Nó cũng được sử dụng vào phát triển thủy tinh nhằm nâng cấp độ bền và khả năng chịu đựng sức nóng.
Ví dụ ví dụ:
Các loại đá granite chứa chấp nhiều khoáng hóa học feldspar.
Các mỏ zeolite tự nhiên được dùng vào xử lý nước và các phần mềm công nghiệp khác.
Vai trò của các hợp hóa học natri vào tự nhiên
Các hợp hóa học natri đóng vai trò quan tiền trọng vào nhiều thừa trình tự nhiên:
Điều hòa áp suất thấm vào: Natri là một trong ion quan tiền trọng vào việc điều tiết áp suất thấm vào vào cơ thể sống. Áp suất thấm vào là áp suất cần thiết để ngăn ngăn sự di chuyển của nước qua màng chào bán ngấm kể từ dung dịch có mật độ chất tan thấp đến hỗn hợp có mật độ hóa học tan cao. Natri góp duy trì sự cân nặng bởi nước giữa bên vào và mặt ngoài tế bào.
Truyền dẫn xung thần kinh trung ương: Natri đóng góp tầm quan trọng quan trọng vào việc truyền dẫn xung thần kinh trung ương. Xung thần kinh là tín hiệu điện được truyền dọc từ những tế bào thần kinh. Sự di đưa của những ion natri và kali qua màng tế bào thần kinh tạo ra sự thay cho đổi năng lượng điện thế, đến phép xung thần kinh được truyền đi.
Duy trì cân bằng năng lượng điện giải: Natri góp giữ lại cân nặng bằng năng lượng điện giải trong cơ thể. Cân bởi điện giải là sự cân nặng bởi giữa các ion đem năng lượng điện tích dương (cation) và những ion mang điện tích âm (anion) vào cơ thể. Natri là cation chính vào dịch nước ngoài bào, giúp giữ lại điện tích dương và cân bằng với những anion như clorua và bicacbonat.
Hình ảnh hưởng đến tính chất của đất: Natri có thể ảnh hưởng trọn đến độ pH, độ mặn, và cấu trúc của đất. Đất có hàm lượng natri cao rất có thể trở thành kiềm, mặn và khó khăn thoát nước, khiến ảnh hưởng đến việc phát triển của cây trồng.
Khai thác và sử dụng các hợp chất natri vào công nghiệp
Các hợp chất natri được khai thác và sử dụng rộng rãi vào công nghiệp:
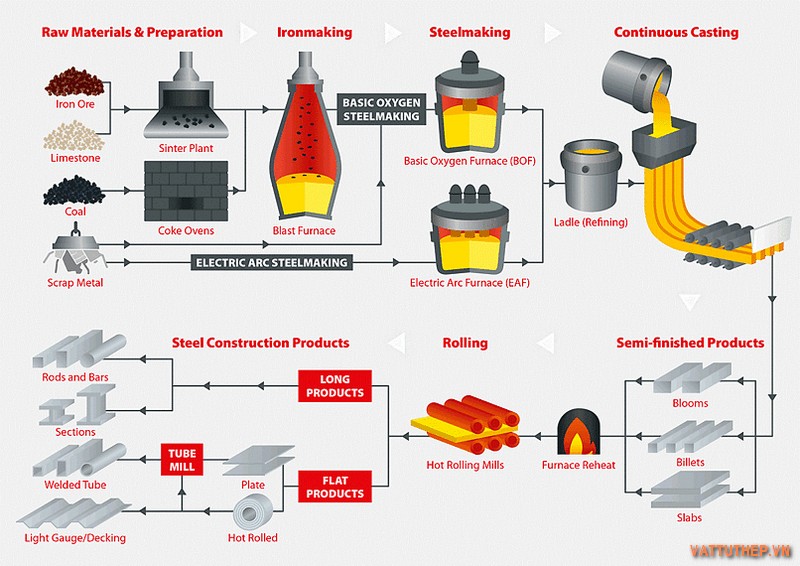
Khai thác muối ăn:
Khai thác từ nước biển bằng cách bay tương đối: Nước biển được đưa vào những ao hồ rộng lớn và nhằm bay tương đối bên dưới ánh nắng mặt trời. Khi nước bay hơi, muối hạt ăn kết tinh và được thu hoạch.
Khai thác từ mỏ muối hạt bởi phương pháp hầm lò hoặc hòa tan:
Phương pháp hầm lò: Đào những hầm lò vào mỏ muối bột và khai thác muối hạt bởi máy móc.
Phương pháp hòa tan: Bơm nước vào mỏ muối bột để hòa tan muối hạt, sau đó bơm dung dịch muối lên mặt đất và mang đến bay hơi nhằm thu hoạch muối bột.
Khai thác natri cacbonat và bicacbonat:
Khai thác từ những mỏ khoáng hóa học: Các khoáng chất chứa natri cacbonat và bicacbonat được khai quật từ những mỏ lộ thiên hoặc hầm lò.
Sử dụng vào công nghiệp:
Sản xuất hóa hóa học (NaOH, clo, axit clohidric, v.v.): Muối ăn là nguyên liệu quan lại trọng để sản xuất NaOH, clo và axit clohidric bằng phương thức năng lượng điện phân.
Sản xuất thủy tinh, giấy, chất tẩy rửa, thực phẩm, dược phẩm, v.v.: Natri cacbonat và bicacbonat được dùng rộng rãi vào tạo ra thủy tinh, giấy, chất tẩy rửa, đồ ăn và dược phẩm.
Ví dụ rõ ràng:
Mô tả quy trình khai thác muối bột ăn kể từ nước biển: Nước biển khơi được bơm vào những ao hồ nước lớn, có diện tích S hàng chục hoặc mặt hàng trăm hecta. Dưới thuộc tính của ánh nắng mặt trời và gió, nước bay hơi dần dần, làm tăng nồng độ muối bột trong ao hồ nước. Khi độ đậm đặc muối đạt đến mức bão hòa, muối bột bắt đầu kết tinh và lắng xuống đáy ao hồ nước. Sau 1 thời gian, người ta thu hoạch muối bởi cơ hội cào muối hạt từ đáy ao hồ và đưa vào nhà máy nhằm chế biến chuyển.
Mô tả các bước tạo ra NaOH kể từ muối ăn bởi phương thức điện phân: Dung dịch muối ăn bão hòa được giả vào phòng năng lượng điện phân, trong đó có hai năng lượng điện cực (anode và cathode) và một màng ngăn. Khi có loại điện chạy qua, muối ăn bị tiêu hủy thành NaOH, khí clo và khí hydro. NaOH được thu gom ở cathode, khí clo được thu gom ở anode, và khí hydro được thu gom ở phía bên trên phòng điện phân.
Kết luận
Trong tự nhiên, natri không tồn trên ở dạng đơn chất do tính hoạt động hóa học tập cao của nó. Thay vào đó, natri tồn trên chủ yếu ớt ở dạng những hợp chất, vào đó phổ biến nhất là muối ăn (NaCl), natri cacbonat (Na2CO3) và natri bicacbonat (NaHCO3).
Các hợp hóa học natri đóng góp vai trò quan lại trọng vào đời sống, công nghiệp và tự động nhiên. Chúng tham gia vào nhiều vượt trình sinh học, được dùng trong nhiều ngành công nghiệp, và ảnh hưởng đến tính hóa học của đất.
Trong tương lai, con người ta cần thiết tiếp tục nghiên cứu và phân tích và phạt triển những phương thức khai quật và dùng những hợp hóa học natri một cách bền vững vàng, đáp ứng mối cung cấp cung cung cấp natri đến những mới sau này.
Giấy quỳ: Công cụ đo pH cho dung dịch NaOH?
April 18, 2025 19:38 - Pas de commentaireCách đo độ pH của NaOH bằng giấy quỳ: Hướng dẫn chi tiết A-Z
Mô tả ngắn chuẩn SEO: Tìm hiểu cách sử dụng giấy quỳ nhằm đo độ pH của dung dịch NaOH một cơ hội chủ yếu xác và an toàn. Bài viết cung cung cấp hướng dẫn từng bước, chú ý quan trọng và giải thích kết quả.
quý khách đang mò cơ hội đo độ pH của dung dịch NaOH một cách thời gian nhanh chóng và đơn giản? Giấy quỳ là một trong lựa chọn tuyệt vời! Trong bài bác viết này, GH Group sẽ hướng dẫn bạn từng bước cách sử dụng giấy quỳ để đo độ pH của NaOH một cơ hội chủ yếu xác và an toàn và tin cậy. Dù quý khách là học sinh, sinh viên, hoặc kỹ thuật viên phòng thí nghiệm, bài xích viết này sẽ cung cấp mang đến quý khách những kiến thức và khả năng muốn thiết nhằm thực hiện tại phép đo này một cách thành công.
Giấy quỳ là gì?
Định nghĩa giấy quỳ và các chủng loại giấy quỳ phổ biến đổi (giấy quỳ xanh, giấy quỳ đỏ).
Giấy quỳ là một trong chủng loại giấy được tẩm hóa học thông tư màu, thông thường được dùng để xác định tính axit hoặc bazơ của một dung dịch. Có hai loại giấy quỳ phổ biến:
Giấy quỳ đỏ: Chuyển quý phái color xanh lúc xúc tiếp với dung dịch bazơ (pH > 7).
Giấy quỳ xanh: Chuyển quý phái color đỏ khi xúc tiếp cùng với hỗn hợp axit (pH < 7).
Trong môi trường trung tính (pH = 7), giấy quỳ không đổi màu.
Nguyên tắc sinh hoạt của giấy quỳ (sự thay đổi color sắc do phản ứng với ion H+ hoặc OH-).
Giấy quỳ sinh hoạt dựa bên trên nguyên lý thay cho đổi màu sắc của hóa học thông tư màu khi tiếp xúc với ion H+ (trong môi trường axit) hoặc ion OH- (trong môi trường bazơ). Chất chỉ thị màu trong giấy quỳ là một trong những axit yếu hoặc bazơ yếu, có kỹ năng thay cho đổi cấu tạo phân tử và màu sắc Khi pH của môi ngôi trường thay đổi.
Ưu điểm và điểm yếu của việc sử dụng giấy quỳ nhằm đo độ pH.
Ưu điểm:
Đơn giản, dễ dàng dùng.
Chi tiêu thấp.
Không cần trang thiết bị phức tạp.
Thích hợp đến việc đo nhanh độ pH gần đúng.
Nhược điểm:
Chỉ cho biết độ pH ngay sát đúng, không thể đo chính xác như máy đo pH.
Kết trái có thể bị ảnh tận hưởng bởi color sắc của dung dịch.
Không thích hợp mang đến các dung dịch có tính lão hóa hoặc loại bỏ mạnh.
Ví dụ: Hình ảnh minh họa những loại giấy quỳ và sự thay cho đổi màu sắc của nó trong môi ngôi trường axit/bazơ.
(Bạn có thể mò kiếm thương hiệu minh họa bên trên Google Images với kể từ khóa "giấy quỳ đo pH" nhằm có hình ảnh trực quan)
Chuẩn bị trước khi đo độ pH của NaOH bởi giấy quỳ
Dụng cụ muốn thiết: Giấy quỳ, hỗn hợp NaOH cần thiết đo, ống nghiệm (hoặc ly nhỏ), đũa thủy tinh (nếu cần).
Giấy quỳ (nên dùng giấy quỳ đỏ vì NaOH là bazơ).
Dung dịch NaOH cần đo độ pH.
Ống nghiệm hoặc ly nhỏ để chứa hỗn hợp NaOH.
Đũa thủy tinh (nếu cần) để khuấy dung dịch.
Đảm bảo an toàn: Đeo kính bảo lãnh, găng tay (vì NaOH có tính ăn mòn).
NaOH là một trong hóa học ăn mòn mạnh, hoàn toàn có thể gây phỏng nếu xúc tiếp thẳng cùng với da hoặc mắt. Do đó, việc đeo kính bảo hộ và găng tay là bắt buộc khi thực hiện việc cùng với NaOH.
Kiểm tra giấy quỳ: Đảm bảo giấy quỳ còn hạn sử dụng và không bị ẩm mốc.
Giấy quỳ không còn hạn sử dụng hoặc bị ẩm ướt có thể đến kết trái không chủ yếu xác. Hãy kiểm tra kỹ giấy quỳ trước Khi sử dụng.
Lưu ý: Nhấn mạnh tầm quan trọng của việc tuân hành các giải pháp an toàn và tin cậy lúc thực hiện việc với NaOH.
An toàn luôn luôn là ưu tiên sản phẩm đầu Khi thực hiện việc với hóa hóa học. Hãy vâng lệnh những cách an toàn nhằm tách hiểm họa và bảo vệ mức độ khỏe mạnh của bạn.
Các bước tiến hành đo độ pH của NaOH bằng giấy quỳ
Bước 1: Lấy một lượng nhỏ dung dịch NaOH vào ống nghiệm (hoặc cốc nhỏ).
Sử dụng pipet hoặc ống hút nhằm lấy một lượng nhỏ hỗn hợp NaOH vào ống nghiệm hoặc cốc nhỏ. Không nên lấy quá nhiều dung dịch để tránh phí phạm và hạn chế nguy cơ tan vỡ.
Cách 2: Nhúng một mẩu giấy quỳ vào hỗn hợp NaOH (chú ý chỉ nhúng một trong mỗi phần nhỏ).
Cầm một mẩu giấy quỳ bằng nhíp hoặc tay (đeo găng tay) và nhúng một trong mỗi phần nhỏ của giấy quỳ vào hỗn hợp NaOH. Không nên nhúng toàn bộ giấy quỳ vào hỗn hợp.
Bước 3: Quan sát sự thay cho đổi màu sắc sắc của giấy quỳ.
Ngay sau Khi nhúng giấy quỳ vào hỗn hợp, hãy quan lại sát sự thay cho đổi màu sắc sắc của giấy quỳ. Màu sắc của giấy quỳ sẽ thay đổi tùy nằm trong vào độ pH của hỗn hợp.
Bước 4: So sánh màu sắc của giấy quỳ cùng với bảng color chuẩn nhằm xác lập độ pH gần đúng của dung dịch NaOH.
So sánh màu sắc của giấy quỳ sau khi nhúng vào dung dịch với bảng màu chuẩn chỉnh đi kèm theo với giấy quỳ để xác định độ pH ngay gần đúng của hỗn hợp NaOH.
Hình ảnh/Video: Minh họa từng bước thực hiện các bước đo độ pH bởi giấy quỳ.
(Bạn có thể mò kiếm đoạn phim phía dẫn trên YouTube với kể từ khóa "đo pH bởi giấy quỳ" nhằm có hướng dẫn trực quan)
Giải quí kết trái đo độ pH
Nếu giấy quỳ đỏ gửi sang color xanh: Dung dịch có tính bazơ (pH > 7).
Vì NaOH là một trong các những bazơ mạnh, giấy quỳ đỏ sẽ đưa quý phái màu sắc xanh khi xúc tiếp với hỗn hợp NaOH.
Nếu giấy quỳ xanh không đổi color hoặc đưa sang màu sắc đỏ: Dung dịch có tính axit (pH < 7) hoặc trung tính (pH = 7).
Trong trường hợp này, rất có thể dung dịch NaOH đã biết thành pha loãng hoặc bị dung hòa do một hóa học axit.
Độ pH của NaOH thông thường cực kỳ cao (ví dụ: pH = 14 đối cùng với dung dịch NaOH 1M).
NaOH có tính axit hay bazơ? dịch NaOH có nồng độ càng cao thì độ pH càng cao. Dung dịch NaOH 1M có độ pH khoảng tầm 14.
Lưu ý: Giải thích rõ ràng ý nghĩa của từng kết trái đo được.
Kết quả đo độ pH bằng giấy quỳ chỉ mang tính hóa học tham khảo. Để có kết quả chính xác rộng, nên sử dụng máy đo pH năng lượng điện tử.
Những lưu ý quan trọng Khi đo độ pH của NaOH bởi giấy quỳ
Không nhúng giấy quỳ trực tiếp vào bình đựng NaOH gốc nhằm tách làm nhiễm bẩn.
Việc nhúng giấy quỳ trực tiếp vào bình đựng NaOH gốc hoàn toàn có thể làm nhiễm bẩn dung dịch và ảnh hưởng đến các phép đo về sau.
Sử dụng giấy quỳ mới mang đến mỗi lần đo nhằm đáp ứng kết quả chính xác.
Giấy quỳ đã sử dụng hoàn toàn có thể bị nhiễm bẩn hoặc mất kỹ năng đổi màu, dẫn đến kết trái không chủ yếu xác.
Đọc kết quả ngay lập tức sau Khi nhúng giấy quỳ vào hỗn hợp, vì color sắc rất có thể thay cho đổi theo thời hạn.
Màu sắc của giấy quỳ có thể thay cho đổi theo thời gian do phản xạ cùng với không khí hoặc các hóa học không giống vào dung dịch.
Giấy quỳ chỉ đến biết độ pH gần đúng, ko thể đo chính xác như máy đo pH.
Nếu muốn đo độ pH chủ yếu xác, nên dùng máy đo pH năng lượng điện tử.
Cảnh báo: Nhắc nhở về những nguy cơ tiềm tàng Khi thực hiện việc với NaOH và cơ hội phòng tách.
Luôn vâng lệnh các giải pháp an toàn và tin cậy khi thực hiện việc với NaOH nhằm tránh tai nạn và đảm bảo mức độ khỏe mạnh của bạn.
So sánh cùng với các cách đo độ pH khác
Ưu điểm và nhược điểm của việc sử dụng giấy quỳ so cùng với máy đo pH điện tử.
Giấy quỳ:
Ưu điểm: Đơn giản, rẻ chi phí, dễ sử dụng.
Nhược điểm: Độ chủ yếu xác thấp, ko quí hợp mang đến những hỗn hợp có màu.
Máy đo pH điện tử:
Ưu điểm: Độ chính xác cao, quí hợp cho nhiều loại dung dịch.
Nhược điểm: Giá thành cao, cần gia hạn và hiệu chuẩn thông thường xuyên.
Khi nà nên dùng giấy quỳ và lúc nào là nên sử dụng máy đo pH.
Sử dụng giấy quỳ Khi cần đo độ pH thời gian nhanh chóng và ko yêu cầu độ chính xác cao.
Sử dụng máy đo pH lúc cần thiết đo độ pH chủ yếu xác và trong các ứng dụng khoa học hoặc công nghiệp.
Giới thiệu về những phương pháp đo độ pH không giống (ví dụ: sử dụng chất thông tư màu).
Ngoài giấy quỳ và máy đo pH năng lượng điện tử, còn tồn tại các phương thức đo độ pH không giống, chẳng hạn như dùng chất chỉ thị color (ví dụ: phenolphtalein, metyl da cam). Mỗi hóa học thông tư màu có một khoảng tầm pH mà nó thay cho đổi color sắc, đến phép xác định độ pH của hỗn hợp.
Trong bài bác viết này, GH Group đã phía dẫn quý khách chi tiết cơ hội đo độ pH của NaOH bằng giấy quỳ. Hy vọng rằng quý khách đã nắm vững vàng những bước thực hiện tại và những chú ý quan lại trọng để có kết trái đo chủ yếu xác và an toàn và đáng tin cậy. Việc đo độ pH là rất quan trọng trong nhiều ứng dụng thực tế, và giấy quỳ là một dụng cụ giản dị và hiệu trái để thực hiện tại phép đo này. Hãy luôn luôn vâng lệnh các giải pháp an toàn Khi làm việc với NaOH và những hóa chất khác nhằm bảo vệ sức khỏe mạnh của quý khách.

